Una crisis de salud pública sin precedentes de abuso de opioides recetados tanto a nivel regional como nacional está afectando actualmente a los Estados Unidos. Si bien las causas subyacentes relacionadas con esta crisis de salud pública son en gran medida especulativas, un posible factor contribuyente es la dramática escalada del tratamiento con opioides recetados para el dolor crónico durante la última década. Los estudios preclínicos apoyan de manera convincente que no solo los opioides ejercen consecuencias negativas para el dolor, sino también que el dolor crónico puede ser dirigido por medicamentos no opioides que carecen de acciones directas sobre las neuronas, lo que reduce la probabilidad de adicción. El tráfico de células inmunes al sistema nervioso central (SNC) y células gliales de tipo inmunológico dentro del SNC (por ejemplo, astrocitos y microglía) es necesario para el desarrollo y mantenimiento de problemas de dolor agudo a crónico a través de una activación neuroinmune inapropiada. Un receptor inmune que se encuentra en el SNC es el receptor tipo Toll 4 (TLR4) que se sabe que induce la liberación de citocinas proinflamatorias, como la interleucina-1b (IL-1b). Los compuestos no opioides que bloquean la vía TLR4-IL-1b pueden proporcionar un beneficio terapéutico sustancialmente mejor que los fármacos opiáceos. Uno objetivo de mi laboratorio es identificar medicamentos no opioides que aprovechan los mecanismos antiinflamatorios endógenos que dan como resultado la supresión de citocinas proinflamatorias como IL-1b, lo que proporciona un enfoque novedoso para tratar el dolor crónico en las personas sin potencial de efectos secundarios adictivos. Además de probar varios compuestos nuevos y aprobados por la FDA, mi laboratorio trabaja en estrecha colaboración con el Centro de Descubrimiento de Fármacos Moleculares de la UNM. http://unmcmd.health.unm.edu para identificar y probar terapias para el dolor potencialmente novedosas que eviten los efectos secundarios relacionados con los opioides.
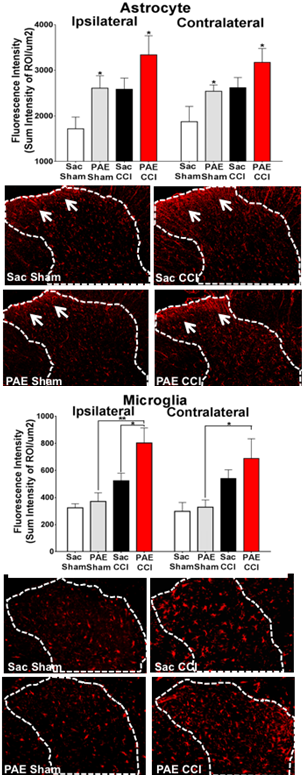
La exposición al alcohol durante la gestación puede conducir a una constelación de discapacidades leves a graves que incluyen déficits cognitivos y conductuales que representan un continuo denominado trastornos del espectro alcohólico fetal (FASD), con una prevalencia de ~ 4.8% en algunas regiones de EE. UU. Un creciente cuerpo de evidencia implica fuertemente el impacto adverso de la exposición al alcohol durante el desarrollo del sistema nervioso central (SNC) en la programación celular y molecular de la función neuroinmune. En modelos animales de exposición prenatal al alcohol (PAE), la expresión de las moléculas de señalización inmunitaria del cerebro, las citocinas proinflamatorias interleucina-1 (IL-1β), el factor de necrosis tumoral alfa (TNF-) y la quimiocina CCL2, están significativamente elevadas. . Si bien se cree que la evidencia de anomalías sensoriales, incluida la sensibilidad táctil, observada en niños con FASD, es el resultado de factores psicosociales, la causa subyacente puede incluir disfunción neurológica. De hecho, los modelos animales de PAE revelan una mayor sensibilidad al tacto ligero, una condición sensorial patológica bien conocida mediada por acciones neuronales aberrantes en la médula espinal. Clínicamente, la hipersensibilidad al tacto se conoce como alodinia en pacientes con dolor crónico, y los modelos animales de alodinia muestran que la activación patológica de las neuronas del dolor se produce en la médula espinal mediada por IL-1β, TNF- y CCL2. Las células gliales (astrocitos y microglía) son productores clave de estas citocinas proinflamatorias. Por tanto, los modelos animales de alodinia y PAE revelan una superposición neuroinmune sorprendente. El objetivo de esta investigación es identificar tipos de células espinales distintos de las neuronas que desempeñan un papel importante en las adaptaciones neuroinmunes en la descendencia de PAE que mejoran la susceptibilidad adulta a la neuropatía. Los resultados proporcionarán nuevos conocimientos para comprender los orígenes del desarrollo de las interacciones inmunes aberrantes del SNC y del SNC debidas a la PAE, lo que revelará la susceptibilidad a enfermedades de aparición en la edad adulta, como el dolor neuropático.
Mi laboratorio trabaja en estrecha colaboración con el Centro de investigación sobre alcohol de Nuevo México (NMARC; Centro de Investigación del Alcohol de Nuevo México ) para comprender los mecanismos neurobiológicos que subyacen a la enfermedad del SNC relacionada con el FASD y utilizar este conocimiento para desarrollar intervenciones más efectivas para los pacientes con FASD.
3. Mecanismos de resistencia a los glucocorticoides en la exposición prenatal al alcohol
Muchos de los procesos fisiológicos afectados por la exposición prenatal al alcohol (PAE) están regulados por glucocorticoides. La resistencia a los glucocorticoides (es decir, la sensibilidad reducida a las acciones de los GC) y la insensibilidad al receptor de glucocorticoides están asociadas con una variedad de enfermedades crónicas, muchas de las cuales están relacionadas con la función inmunitaria y también con la PAE. El enfoque de la investigación es analizar si el PAE produce insensibilidad al receptor de glucocorticoides que se expresa como una desregulación del eje hipotalámico pituitario y un aumento de las citocinas proinflamatorias cerebrales y disminución de las citocinas antiinflamatorias en condiciones estresantes, y si un cambio en el desarrollo del estrés normal e inmunológico. Las respuestas durante la vida temprana son observables, y si estos cambios persisten hasta bien entrada la edad adulta. El objetivo de la investigación de mi laboratorio es identificar los mecanismos moleculares subyacentes a las alteraciones en la programación de la sensibilidad a los glucocorticoides durante el desarrollo del SNC que persisten hasta la edad adulta. Esta información se utilizará para desarrollar intervenciones dirigidas que reviertan o reduzcan los efectos del PAE sobre la sensibilidad del receptor de glucocorticoides y las respuestas de las moléculas de señalización neuroinmunitaria. Para lograr estos objetivos, mi laboratorio colabora con el Centro de Investigación del Alcohol de Nuevo México (NMARC; Centro de Investigación del Alcohol de Nuevo México).