Investigador principal:
Matthew Campen, doctorado
Maestro,
colegio de Farmacia
MCampen@salud.unm.edu
(505) 272-3329
Dirección física del laboratorio
Edificio de farmacia de enfermería, sala B-3
Dirección postal del laboratorio
Departamento de ciencias farmacéuticas
MSC09 5360
1 Universidad de Nuevo México
Albuquerque, NM 87131-0001

Top: Jessica Begay (estudiante de maestría), Tamara Young (estudiante de doctorado), Alexis Wilson (estudiante de UPN), Raul Salazar (estudiante de farmacia), Katherine Zychowski, Ph.D. (Profesor Ayudante de Investigación).
Abajo: Matthew Campen, Ph.D. (Profesor), Guy Herbert (especialista en investigación) Russell Hunter (estudiante de doctorado), Selita Lucas (especialista en investigación), Jesse Denson, Ph.D. (Director de comunicaciones científicas), Thomas Wilson (estudiante de doctorado en farmacia), Barry Bleske, doctorado en farmacia. (Cátedra, Práctica de Farmacia y Ciencias Administrativas).
El Dr. Campen dirige el Laboratorio de Toxicología Cardiovascular en el Departamento de Ciencias Farmacéuticas. Junto a sus colegas Barry Bleske, Pharm.D. y Katherine Zychowski, Ph.D., el grupo investiga principalmente los impactos cardiovasculares de los tóxicos ambientales. La investigación actual implica comprender cómo los tóxicos inhalados, incluidos los nanomateriales, las partículas derivadas de las minas de uranio y el ozono, pueden afectar negativamente a los vasos sanguíneos de todo el cuerpo.
El Dr. Campen dirige el Programa de Desarrollo de Carrera con Mentores de KL2 dentro del Centro de Ciencias Clínicas y Traslacionales de la UNM. También es Subdirector de la Evaluación de la exposición y toxicidad de metales de UNM en tierras tribales del suroeste (UNM METALS) Superfund Research Program Center. Estos programas enfatizan la traslación de la investigación en salud ambiental y toxicología de un banco a la cama, o de un banco a una zanja, como en el caso del trabajo comunitario, y esta relevancia traslacional está incorporada en gran parte del enfoque del Laboratorio de Toxicología Cardiovascular.
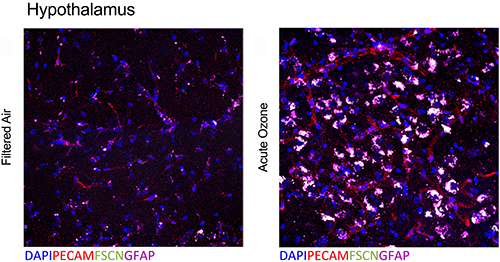
Deterioro traslapado de la barrera hematoencefálica (BBB) y activación de astrocitos en la unidad neurovascular después de una exposición aguda al O3 (Tyler et al., Toxicol Sci, 2019).
La contaminación del aire, especialmente el material particulado (PM), tiene un impacto sustancial en la salud mundial, y la Organización Mundial de la Salud estima 800,000 muertes cardiopulmonares anuales en exceso a través de mecanismos que no están del todo claros. El trabajo en curso en nuestro programa ha revelado interacciones potenciadoras entre la PM de la fuente de combustión y los componentes gaseosos asociados que pueden mejorar la toxicidad vascular sistémica. A pesar de la barrera protectora que ofrece el pulmón, el endotelio vascular sistémico es un objetivo vulnerable de la toxicidad de la contaminación del aire y sensible a las combinaciones de componentes de gases y partículas. Los resultados clásicos de la activación endotelial inflamatoria son observables en animales y seres humanos expuestos a una amplia variedad de contaminantes; tales respuestas son fundamentales para el desarrollo temprano de la aterosclerosis y también para eventos en etapas tardías, como la inestabilidad y la rotura de la placa. Lo que no está claro es la vía por la cual la toxicidad de la contaminación del aire se transfiere del pulmón a la vasculatura. Postulamos que la activación endotelial inflamatoria surge después de la inhalación de contaminantes del aire debido a modificaciones oxidativas de los componentes sanguíneos y refleja un modo de acción común para muchos contaminantes. El plasma obtenido de humanos expuestos a diésel o dióxido de nitrógeno activa las células endoteliales, lo que sugiere que la transferencia de toxicidad desde el pulmón a los vasos sistémicos se lleva a cabo en el torrente sanguíneo. Los receptores de reconocimiento de patrones y captadores de múltiples ligandos en las células endoteliales, incluido el receptor similar a la lectina para LDL oxidada (LOX-1) y CD36, pueden representar una unión focal que reduce las alteraciones séricas complejas a respuestas patológicas vasculares comunes. Los objetivos del proyecto renovado son ampliar dos hallazgos clave del proyecto original: 1) los gases y las PM interactúan para mejorar la toxicidad vascular y 2) los contaminantes inhalados aumentan el potencial inflamatorio circulante. Por lo tanto, en el Objetivo 1, aclararemos las interacciones entre las partículas orgánicas volátiles y las partículas que conducen a la toxicidad vascular sistémica. Aquí, planteamos la hipótesis de que la combinación de PM con la porción gaseosa de las emisiones de los vehículos de motor mejorará la toxicidad vascular de una manera que depende del área de superficie y la composición de la PM. En Aim 2, mediremos el potencial inflamatorio circulante en relación con los componentes de las emisiones combinadas del motor y analizaremos los resultados utilizando métodos estadísticos novedosos diseñados para mezclas complejas. Nuestra hipótesis es que la potencia de la activación aguda de las células endoteliales por factores circulantes dependerá de la dosis, se verá agravada por las fases combinadas de PM y gas, y se correlacionará con la remodelación vascular crónica y el estrés oxidativo. Por último, en el objetivo 3, delinearemos la contribución relativa de CD36 y LOX-1 en la conducción de la generación pulmonar y la respuesta endotelial a los factores circulantes inducidos por O3 y MVE. Nuestra hipótesis es que, a pesar de la compleja química atmosférica y los cambios en la composición del suero con la exposición a la contaminación, los receptores multiligando CD36 y LOX-1 median la respuesta endotelial y la inactivación de la NOS.
(con el Dr. Andrew Ottens, a continuación):
Los nanomateriales artificiales (ENM) tienen un potencial tóxico desconocido y la relación entre los efectos biológicos y las propiedades fisicoquímicas sigue siendo incierta. Nuestro objetivo de investigación a largo plazo es permitir un perfil de seguridad eficiente y preciso de ENM de diversas características y condiciones de exposición que mejorarían la toma de decisiones con respecto a los riesgos de exposición humana. Nuestro objetivo en esta aplicación es determinar los cambios en la composición del suero que resultan de la exposición pulmonar a ENM que conducen a toxicidad sistémica (vascular y neural, principalmente). Proponemos los siguientes objetivos específicos, que combinarán innovadoras salidas de bioactividad ex vivo con análisis de composición avanzados de espectrometría de masas de alta resolución. En el primer Objetivo, averiguaremos los mecanismos de origen pulmonar de los componentes circulatorios modificados relacionados con la actividad de las metaloproteinasas y la inflamación. La evidencia sugiere que los factores circulantes pueden estar relacionados con a) reacciones directas de ENM y componentes celulares / moleculares pulmonares ob) subproductos de degradación del aumento de la actividad metaloproteinasa y que los componentes circulantes actúan a través de receptores de reconocimiento de patrones de superficie de células endoteliales. En el segundo objetivo, evaluaremos los impactos neurovasculares y del sistema nervioso central que surgen de las modificaciones de los seromas pulmonares inducidas por el ENM. Aquí, desarrollaremos y optimizaremos un algoritmo basado en etiquetas de secuencia para mejorar la identificación de péptidos endógenos dentro del seroma que responde a nanotubos de carbono de paredes múltiples (MWCNT), lo que facilitará la evaluación de la bioactivación inducida por ENM en la cerebrovasculatura y la difusividad. de factores serómicos sensibles a ENM a través de la barrera hematoencefálica. Por último, en el tercer objetivo, evaluaremos las características circulatorias asociadas a MWCNT y el potencial inflamatorio en muestras derivadas de una cohorte expuesta ocupacionalmente. Evaluaremos la bioactividad sérica en términos de activación endotelial y la vincularemos con las mediciones de la zona de respiración personal de carbono elemental, un marcador de exposición a nanotubos / nanofibras de carbono. Al finalizar este proyecto, esperamos haber identificado los factores fisiológicos y químicos clave que influyen en la toxicidad de ENM transmitida por plasma. Se espera que la finalización con éxito de estos estudios constituya un paso importante hacia la prevención / atenuación de los efectos adversos para la salud asociados con la exposición a ENM.
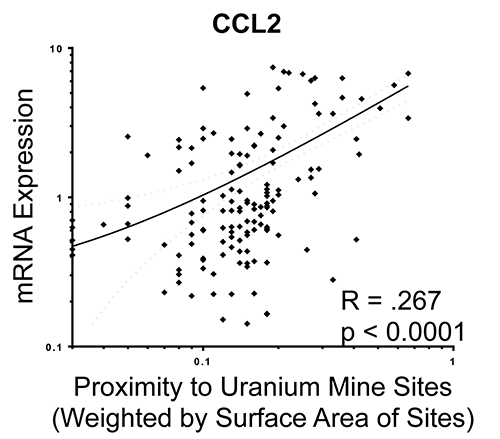
Gráfico de regresión lineal de asociaciones ponderadas de proximidad de minas de uranio abandonadas con ARNm del ligando 2 de quimiocinas (CCL2) de las respuestas de las células endoteliales al suero del participante (Harmon et al., JESEE, 2017).
Las enfermedades cardiovasculares y metabólicas están aumentando a nivel nacional y un creciente cuerpo de evidencia destaca el papel de los contaminantes ambientales como factores coadyuvantes de las enfermedades cardiovasculares (ECV). En Nuevo México y la Nación Navajo, existen muchas regiones mineras abandonadas y no reparadas que continúan contaminando la tierra, el agua y el aire. La inhalación de material particulado (PM) rico en metales de los desechos de la minería puede representar un riesgo no reconocido de enfermedad cardiovascular y pulmonar en las comunidades afectadas. Existe un fuerte vínculo entre los metales en la PM en el aire y los resultados cardiovasculares y pulmonares adversos, especialmente la enfermedad vascular inflamatoria crónica. Sin embargo, gran parte de la toxicología se ha centrado en formas solubles de metal, que son más relevantes para la quema de aceite residual en la industria del transporte marítimo. Hay numerosos sitios en el suroeste de los EE. UU. Donde los desechos mineros han provocado una grave contaminación del suelo por mezclas de metales, lo que ha provocado altos niveles de uranio (U), cobre (Cu), vanadio (V), níquel (Ni) y arsénico (As ), entre otros. Evaluaremos los impactos aterogénicos directos e indirectos del material particulado inhalado obtenido de comunidades con antecedentes de contaminación por metales mixtos. El modelo de trabajo se relaciona con interacciones complejas en el pulmón que conducen a productos circulatorios secundarios que inducen respuestas inflamatorias del endotelio vascular. Los receptores inmunomoduladores, como CD36, TLR4 y el receptor similar a la lectina para lipoproteínas de baja densidad oxidadas (LOX-1) median las respuestas vasculares a otros componentes sólidos y gaseosos de la contaminación del aire. El impacto de los metales en la conducción de las respuestas inmunitarias innatas vasculares es poco conocido. Presumimos que las exposiciones pulmonares a partículas ricas en metales de regiones tribales contaminadas con desechos mineros generarán factores circulantes como el LDL oxidado, que a su vez activará la respuesta inflamatoria y la disfunción en las células endoteliales, que dependen de los receptores inmunomoduladores. Los siguientes objetivos abordarán esta hipótesis de una manera mecanicista y traslacional. En el primer objetivo, compararemos la potencia de las muestras de polvo inhalado de las regiones mineras en términos de conducción de la toxicidad vascular sistémica y el potencial inflamatorio sérico. En el segundo objetivo, examinaremos el papel de oxLDL y los receptores inmunomoduladores en la conducción de la activación y disfunción endotelial derivada de la exposición a PM rico en metales. Antagonizaremos selectivamente la vía oxLDL / LOX-1 in vivo e in vitro para evaluar los resultados de la disfunción endotelial y la inflamación vascular. Por último, en el tercer objetivo, modelaremos exposiciones a favor del viento en una cohorte navajo para examinar las asociaciones con los marcadores circulantes de lesión endotelial y potencial inflamatorio sérico. Modelaremos las exposiciones al polvo arrastrado por el viento y las vincularemos con los resultados de los marcadores de lesiones inflamatorias / endoteliales (LDLx, ICAM soluble y VCAM, endotelina-1) y la bioactividad sérica de una cohorte de 252 miembros de la Nación Navajo.
Tyler CR, Zychowski KE, Sánchez BN, Rivero V, Lucas S, Herbert G, Liu J, Irshad H, McDonald JD, Bleske BE, Campen MJ. La dependencia del área de superficie de las interacciones gas-partícula influye en los resultados pulmonares y neuroinflamatorios. Parte Fibra Toxicol. 13:64, 2016. PMID: 27906023; PMC5131556
Zychowski KE, Sánchez B, Pedrosa RP, Lorenzi-Filho G, Drager LF, Polotsky VY, Campen MJ. El suero de pacientes con apnea obstructiva del sueño induce respuestas inflamatorias en las células endoteliales de las arterias coronarias. La aterosclerosis. 254: 59-66, 2016. PMID: 27693879; PMC5097675
Harmon ME, Lewis J, Miller C, Hoover J, Ali AS, Shuey C, Cajero M, Lucas S, Pacheco B, Erdei E, Ramone S, Nez T, Gonzales M, Campen MJ. Proximidad residencial a las minas de uranio abandonadas y potencial inflamatorio del suero en comunidades navajos crónicamente expuestas. J Exposición Sci Environ Epidemiol.27: 365-371, 2017. PMID: 28120833; PMC5781233
Aragón M, Topper L, Tyler CR, Sanchez BN, Zychowski KE, Young T, Herbert G, Hall P, Erdely A, Eye T, Zeidler-Erdely P, Ottens AK, Campen MJ. La bioactividad transmitida por el suero causada por la exposición pulmonar a nanotubos de carbono de paredes múltiples induce neuroinflamación a través del deterioro de la barrera hematoencefálica. Proc Natl Acad Sci USA, 114: E1968-E1976, 2017. PMID: 28223486; PMC5347541
Zychowski KE, Kodali V, Harmon M, Tyler CR, Sanchez B, Ordonez Suarez Y, Herbert G, Wheeler A, Avasarala S, Cerrato JM, Kunda NK, Muttil P, Shuey C, Brearley A, Ali AM, Lin Y, Shoeb M, poco A, Campen MJ. La materia particulada respirable que contiene uranil-vandato derivada de un sitio de mina de uranio heredado exhibe toxicidad cardiopulmonar potenciada. Toxicol Sci. 164: 101-114, 2018. PMID: 29660078; PMCID: PMC6016706.
Tyler CR, Noor S, Young TL, Rivero V, Sánchez B, Lucas S, Caldwell KK, Milligan ED, Campen MJ. El envejecimiento exacerba los resultados neuroinflamatorios inducidos por la exposición aguda al ozono. Toxicol Sci.163: 123-139, 2018. PMID: 29385576; PMC5920500
Mostovenko E, Young T, Muldoon PP, Bishop L, Canal CG, Vucetic A, Zeidler-Erdely PC, Erdely A, Campen MJ, Ottens AK. El peptidoma bioactivo circulante impulsado por la exposición a nanopartículas causa inflamación sistémica y disfunción vascular. Parte Fibra Toxicol. 16:20, 2019. PMID: 31142334; PMC en curso.
Matthew Campen, doctorado
Profesor, Investigador Principal,
Facultad de Farmacia de la UNM
Dirección Física
Edificio de enfermería / farmacia
2502 Mármol Ave. NE
Suite B-3
Albuquerque, NM 87131-0001
Dirección Postal
Departamento de ciencias farmacéuticas
MSC09 5360
1 Universidad de Nuevo México
Albuquerque, NM 87131-0001